
L’actualité nous le rappelle. Un simple virus peut être à l’origine d’une crise sanitaire et financière à l’échelle mondiale. Cet article ne vise pas à s’étendre sur la crise sanitaire sans pareil que nous vivons actuellement. Cependant, elle m’a remémoré l’impact des virus sur les êtres vivants. Je me suis rappelé les résultats des travaux de mes anciens collègues microbiologistes (que je salue au passage), il y a 5 ans, mettant en évidence la présence de génomes viraux en quantité dans les réacteurs anaérobies, dont 50% étaient encore inconnus au bataillon (Calusinska et al., 2015). Sur base de ces résultats, notre chef d’unité s’était posé cette question: « Et si certains réacteurs anaérobies pouvaient subir une attaque virale, et donc, en simplifié, pouvaient-ils attraper une bonne grosse grippe? ». On le sait, il arrive que certains réacteurs, même en laboratoire, inoculés, conduits et alimentés identiquement, peuvent avoir des rendements et comportements différents. Les communautés bactériennes évoluent différemment… …et si les virus pouvaient parfois être la cause de ces variations? Et si une communauté clef de bactéries ou archées dans un réacteur subissait les ravages d’un phage (virus), avec comme conséquence une fragilisation de cette chaîne trophique qu’est la digestion anaérobie?
« Et si certains réacteurs anaérobies pouvaient subir une attaque virale, et donc, pourraient-ils tomber malade? »
Cet article n’adresse pas le devenir des agents pathogènes animaux et végétaux au travers du processus de digestion anaérobie. Non, ici, je désire parler d’une part de la digestion anaérobie encore trop peu connue et disséminée: les virus en présence dans les réacteurs. Les virus qui s’attaquent aux bactéries sont dits des « phages » ou « bactériophages ». Loin d’être un microbiologiste, ni un virologue ou pathologue, le but de cet article est de mettre en évidence toute l’importance et la complexité de la vie dans un digesteur anaérobie, dont on sait encore très peu au final, surtout au niveau des interactions et interdépendances.
Justement, j’aimerais commencer par parler de cette vie présente dans un digesteur anaérobie. Imaginez! Votre digesteur de 1800 m³, anaérobie, température de 40°C, pH de 7,9, un taux de matière sèche de 9,2%, tout cela en mélange continu, et un peu d’oxygène gazeux pour la désulfurisation biologique. Oui, en général, c’est tout ce dont disposons comme information de cet univers complexe où vivent de quelques milliards à quelques dix mille milliards d’archées dans un millilitre de ce liquide, cela, sans compter les bactéries hydrolytiques, acidogènes et acétogènes. Les archées méthanogènes, ces sont ces petites mains ouvrières de la méthanisation, ces mains sans qui le biogaz ne peut être produit. Leur travail est précédé par celui des bactéries qui dégraderont la matière organiques en des molécules plus simples, source de nourriture des archées méthanogènes. Un millilitre de digestat contient plus d’archées que la planète terre n’abrite d’êtres humains. Un réacteur anaérobie, c’est un univers en soi, ou plutôt, un écosystème.
Un millilitre de digestat contient plus de méthanogènes que la planète terre n’abrite d’êtres humains, voire même jusqu’à 10 000 fois plus!
Les digesteurs comme un « écosystème »
Lorsque nous démarrons un réacteur anaérobie, nous créons des conditions artificielles, un biotope, un lieu où accueillir une biocénose, une communauté d’êtres vivants, et une chaîne trophique, avec au bout de cette chaîne, la production de biogaz. Nous cherchons à conserver un pH optimum et stable, un pouvoir tampon suffisant, une pression osmotique stable, etc. Cet écosystème est fragile. On le remarque bien. Une simple variation de température du digesteur, voire un simple problème de mélange induit rapidement une modification de l’équilibre: on observera un pic d’émission d’hydrogène ou monoxyde de carbone, un phénomène ponctuel d’accumulation de mousse, etc. Un écosystème est formé de deux composantes: le biotope et la biocénose. Le biotope, ce sont les caractéristiques physiques de l’écosystème: température, pH, etc. La biocénose, c’est la communauté d’êtres vivants qui y sont présents. Lorsque nous mesurons la température, le FOS/TAC, le pH, les AGV, nous mesurons la qualité du biotope, du milieu. Nous mesurons, très superficiellement, les conditions dans lesquels organismes de ce milieux vivent mais nous ne savons rien de leur population et de leur état sanitaire. Lors d’un écart important de température, d’une acidification importante, de l’introduction d’antibiotiques/xénobiotiques, quel a été l’impact sur la communauté vivante, une fois revenu à des conditions plus propices? Que sont devenues les populations bactériennes et archées? Les avons-nous modifiées? Avons-nous réduit certaines populations, voire éradiqué une espèce ou un groupe d’espèces? Il n’est possible de répondre à ces questions que par des méthodes coûteuses et complexes liées à la métagénomique (entre autres). Les techniques actuelles de suivi de digesteurs anaérobies analysent et caractérisent le biotope et non pas la biocénose d’un digesteur. Et la biocénose alors?
Les techniques actuelles de suivi de digesteurs anaérobies analysent et caractérisent le biotope et non pas la biocénose d’un digesteur.
Le suivi de process actuel des digesteurs anaérobies s’axe sur le biotope. La biocénose est très peu suivie, par manque de moyens techniques, et aussi parce qu’elle est encore fortement méconnue, surtout au niveau des interdépendances et interactions. Les archées méthanogènes sont des êtres très sensibles. Elles requièrent des conditions très strictes d’anaérobiose, de température, de pH, et de plus, leur multiplication est lente. Une population d’archées double dans un laps de temps de quelques jours à une semaine. D’un autre côté, les bactéries hydrolytiques sont plus « universelles », plus résistantes et plus diversifiées. Anaérobe-facultatives, tolérantes à de fortes variations de pH, plus tolérantes aux variations de températures, elles doublent leur population en termes de quelques heures. Imaginons, dès lors, une pandémie virale touchant certaines populations bactériennes, notamment, les archées, la branche fragile de la chaîne trophique et de la production de biogaz, car celles-ci mettent du temps à recréer leurs populations. Est-ce possible?
Les virus dans les digesteurs
En soi, un digesteur présente toutes les conditions pour une multiplication des virus (dits phages pour les bactéries): une concentration importante de bactéries et archées, une mélange dit « infini » qui facilite le contact et la dissémination des particules virales. En 2014, mes collègues microbiologistes se sont intéressés aux particules virales présentes dans neuf digesteurs anaérobies, incluant des digesteurs de boues de station d’épuration (STEP), des digesteurs alimentés avec des substrats uniquement agricoles et finalement des réacteurs alimentés avec des résidus industriels agro-alimentaires et des cultures énergétiques. L’estimation du nombre d’espèces de virus par digesteur était de 2000 à 12000 (Calusinska et al., 2015). Le chiffre impressionne. De plus, 50% des génomes viraux étaient d’origine inconnue… …tout un univers encore à découvrir! Il est à remarquer que la plupart des virus détectés sont des bactériophages et des virus pathogènes aux végétaux. Même dans les unités de méthanisation de stations d’épuration d’eaux usées, les virus potentiellement pathogènes aux animaux and humains étaient très rares.
L’estimation du nombre d’espèces de virus par digesteur était de 2000 à 12000.
L’analyse microscopique permet bien d’observer la diversité des virus dans les digestats. La figure ci-dessous (copyright CC: Calusinska et al. 2015) montre quelques types de particules virales obersvées dans les digesteurs. Depuis des formes de bâtonnets en passant par les formes de citron ou filamenteuses, les virus sont très diversifiés et nombreux dans les digesteurs anaérobies.
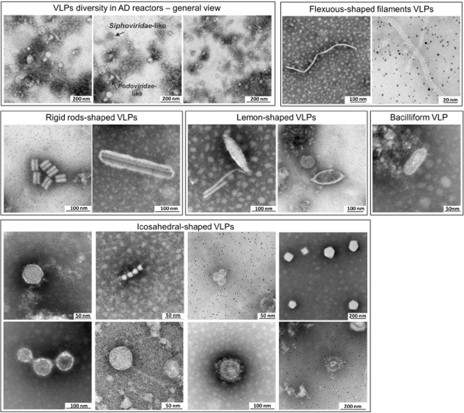
Pour revenir sur une publication un peu plus récente, dans leur analyse de métaprotéomique (analyses de l’ensemble des protéines) sur de nombreux digesteurs, Heyer et ses collaborateurs ont observé que 0,4% des protéines dans les digesteurs étaient d’origine virale (Heyer et al., 2019). Ils ont remarqué que la plupart des phages rencontrés dans les digesteurs s’attaquaient plutôt aux bactéries qu’aux archées. Aussi, par une série d’hypothèses, ils estiment grossièrement le nombre de phages à « 4 phages pour une cellule bactérienne ». Cependant, dans ce monde sauvage, chacun sait se défendre. Heyer et ses collaborateurs ont aussi étudié les protéines dites « CRISPR », ces protéines qui permettent aux bactéries de lutter contre les phages et de les détruire. Une sorte d’immunité des bactéries face aux virus. Celles liées aux archées étaient plus abondantes que celles liées aux bactéries. Par un raccourci rapide, on pourrait dire que les archées se défendent plus/mieux des phages que les bactéries, et c’est tant mieux, vu leur faible vitesse de doublement.
Et l’impact des phages sur nos digesteurs?
Pour certaines bactéries telles que Clostridiaceae et Enterobacteriaceae, Heyer et al. estime même le nombre de phages à 20-30 phages par cellule de ces bactéries. La guerre avec les phages n’est pas donc égale pour toutes les bactéries! Hors, la famille des Clostridiaceae joue un rôle important dans la dégradation des polymères complexes, notamment la cellulose. Et donc, les phages, dans ce cas, peuvent avoir un impact direct sur la production de biogaz, notamment les boues d’eaux usées et les unités agricoles ou la cellulose présente une portion importante des substrats! Heyer et al. tempère cependant sa discussion. En effet, comme il y a toujours des difficultés à assigner les protéines des phages à des hôtes bien spécifiques, il est difficile de savoir si la destruction de cellules (lyse) a un impact important sur les voies de dégradation de la matière organique, et donc de la production de biogaz et s’il s’agit d’un évènement rare et transitoire. De plus, la lyse (destruction cellulaire) de bactéries offre aussi la disponibilité de nombreux nutriments (vitamines, sucres, acides aminés) qui stimulent la croissance d’autres membres de la communauté. Les phages ont certainement une place importante dans l’économie circulaire en place dans les digesteurs, en fournissant aux communautés microbiennes en place des éléments essentiels et/ou bio-disponibles via la lyse des bactéries. Tout n’est donc pas négatif avec les phages.
Une autre publication scientifique s’intéressant aux phages dans les digesteurs apporte une information supplémentaire de l’impact des phages dans les digesteurs. Zhang et al. (2017) s’est intéressé aux interactions procaryotes (bactéries) – phages dans des digesteurs de station d’épuration d’eaux usées. Il a remarqué que les variations des communautés bactériennes étaient expliquées à 40% par la présence de phages, alors que les modifications des paramètres physico-chimiques tels que la DCO, la matière sèche, la matière organique sèche, le pH, la concentration en Fe, Cu, Cr, Cl− et sulfates n’expliquaient que 14% des variations des communautés microbiennes. Donc oui, certainement, les phages influencent certainement de manière significative les populations microbiennes des digesteurs, même si tout est encore à apprendre.
On rencontre souvent dans les unités de méthanisation une formation excessive de mousse sans réelle explication, et cela, parfois, sans avoir modifié les conditions ni la ration du digesteur. La lyse cellulaire provoquée par une abondance excessive de phages dans un digesteur résultera en une libération de protéines microbiennes qui pourraient avoir un impact important sur la stabilité de la mousse dans les digesteurs. Voici une hypothèse qui mériterait la peine d’être investiguée, non? quand on pense aux conséquences économiques des excès de mousse en méthanisation, et le peu de moyens d’y remédier, surtout lors d’un évènement abrupte d’accumulation de mousse.
Pour conclure cet article, les virus, nombreux et diversifés, influencent et modifient très certainement les populations bactériennes dans les digesteurs, mais on ne connait pas l’effet au niveau macroscopique sur les digesteurs. Les phages sont très abondants dans les digesteurs mais aussi, très méconnus. Pourtant, il est fort possible que l’abondance et l’activité des phages dans les digesteurs aient un impact sur la performance des digesteurs et la bonne digestion des substrats, mais aussi sur la formation de mousse et sans doute d’autres paramètres mais, pour le moment, tout est encore à découvrir.
Je m’arrête ici. Le sujet est long et complexe. J’espère avoir trouvé l’équilibre entre la rigueur scientifique et la vulgarisation du sujet, que je veux accessible à toute personne intéressée par la méthanisation. N’hésitez pas à commenter ce post dans un esprit constructif.
Prenez soin de vous en cette période difficile. Et pour les méthaniseurs, prenez soin de vos digesteurs.
Gilles ADAM
Références
Calusinska, M., Marynowska, M., Goux, X., Lentzen, E., Delfosse, P. (2015). Analysis of dsDNA and RNA viromes in methanogenic digesters reveals novel viral genetic diversity. Environmental microbiology. 18. https://doi.org/10.1111/1462-2920.13127.
Heyer, R., Schallert, K., Siewert, C. et al. Metaproteome analysis reveals that syntrophy, competition, and phage-host interaction shape microbial communities in biogas plants. Microbiome 7, 69 (2019). https://doi.org/10.1186/s40168-019-0673-y
Zhang, J., Gao, Q., Zhang, Q. et al. Bacteriophage–prokaryote dynamics and interaction within anaerobic digestion processes across time and space. Microbiome 5, 57 (2017). https://doi.org/10.1186/s40168-017-0272-8

Commentaires récents